En química, la "presión parcial" se refiere a las presiones que cada gas en una mezcla de gases que se ejerce en contra de su entorno, como una muestra del matraz, un buzo en el tanque de aire, o el límite de una atmósfera. Se puede calcular la presión de cada gas en la mezcla si usted sabe cuánto de eso hay, ¿qué volumen ocupa, y su temperatura. A continuación, puede agregar estas presiones parciales juntos para encontrar la presión total de la mezcla de gases, o, usted puede encontrar el total de la presión primero y luego buscar las presiones parciales.
Medidas
@@_
@@
1
la Comprensión de las Propiedades de los Gases


1
@@_
@@Tratar cada gas como un 'ideal' de gas. Un gas ideal, en la química, es la que interactúa con otros gases sin ser atraídos a sus moléculas. Las moléculas individuales pueden golpear el uno al otro y rebotan como bolas de billar, sin deformarse en forma alguna.[1]
- Las presiones de los gases ideales, aumentar a medida que se reducen a espacios más pequeños y disminuir a medida que se expanden en áreas más grandes. Esta relación se denomina Ley de Boyle, después de que Robert Boyle. Está escrito matemáticamente como k = P x V o, más simplemente, k = PV, donde k representa la constante relación, P es la presión y V representa el volumen.[2]
- Presiones puede ser determinado usando uno de los varios posibles unidades. Uno es el pascal (Pa), que se define como una fuerza de un newton aplicado sobre un metro cuadrado. Otra es la atmósfera (atm), que se define como la presión de la atmósfera de la Tierra a nivel del mar. Una presión de 1 atm es igual a 101,325 Pa.[3]
- las temperaturas de Los gases ideales, como aumentar sus volúmenes de aumento y disminución de sus volúmenes disminuir. Esta relación se denomina Ley de Charles después de Jacques Charles. Está escrito matemáticamente como k = V / T, donde k representa la constante relación entre el volumen y la temperatura, V de nuevo representa el volumen, y T representa la temperatura. [4][5]
- Temperaturas de los gases en esta ecuación se expresa en grados Kelvin, que se encuentran por la adición de 273 para el número de grados Celsius en el gas de la temperatura.
- Estas dos relaciones se pueden combinar en una sola ecuación: k = PV / T, que también puede ser escrito como PV = kT.


2
@@_
@@Definir las cantidades de los gases se miden en. Los Gases tienen masa y volumen. El volumen se suele medir en litros (l), pero hay dos tipos de masa.
- Convencional de la masa se mide en gramos o, si no es suficientemente grande de masa, en kilogramos.
- Porque de lo ligero de los gases generalmente, están también mide con otra forma de masa llamada masa molecular o masa molar. La masa Molar se define como la suma de los pesos atómicos de cada átomo en un compuesto, el gas está compuesto de, con cada átomo comparado contra el valor de 12 de carbono.[6]
- Porque los átomos y las moléculas son demasiado pequeños para trabajar con cantidades de gases se define en moles. El número de moles presentes en una determinada gas se puede encontrar dividiendo la masa por la masa molar y puede ser representado por la letra n.
- se puede sustituir la arbitrariedad de la constante k en la ecuación de los gases con el producto de n, el número de moles (mol), y una nueva constante R. La ecuación puede ahora escribirse nR = PV/T o PV = nRT.[7]
- El valor de R depende de las unidades utilizadas para medir los gases' las presiones, volúmenes y temperaturas. Para el volumen en litros, la temperatura en grados Kelvin, y la presión en atmósferas, su valor es 0.0821 L atm/K mol. Esto también puede ser escrito 0.0821 L atm K-1 mol -1 para evitar el uso de la división diagonal con las unidades de medida.[8]
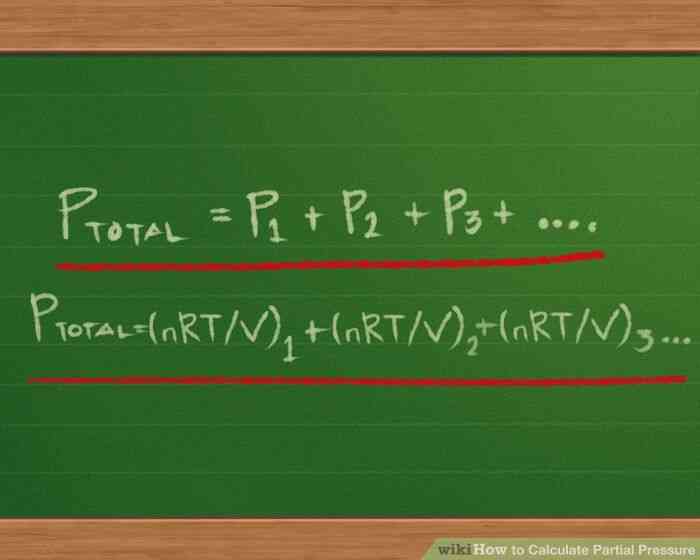
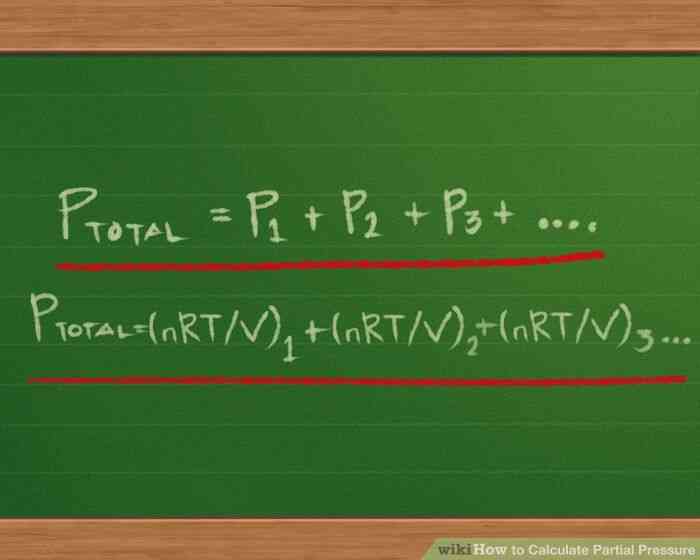
3
@@_
@@Entender la Ley de Dalton de las Presiones Parciales. Desarrollado por el químico y el físico John Dalton, quien primero propuso el concepto de elementos químicos que se compone de átomos,[9][10][11] la Ley de Dalton establece que la presión total de una mezcla de gases es la suma de las presiones de cada uno de los gases en la mezcla.
- la Ley de Dalton puede ser escrito en forma de ecuación como Ptotal = P1 P2 P3 ... con tantos sumandos después del signo igual como hay gases en la mezcla.
- La Ley de Dalton de las ecuaciones puede ser ampliado cuando se trabaja con gases cuyos presiones parciales son desconocidos, pero para los que sabemos de sus volúmenes y temperaturas. Un gas de la presión parcial es la misma presión que si la misma cantidad de gas que fueron el único gas en el recipiente.[12]
- Para cada una de las presiones parciales, podemos reescribir la ecuación del gas ideal, de modo que en lugar de la forma PV = nRT, nosotros sólo puede tener P en el lado izquierdo del signo igual. Para ello, dividimos ambos lados por V: PV/V = nRT/V. Las dos V en el lado izquierdo cancelar, dejando P = nRT/V
- luego podemos sustituir cada subíndice P en el lado derecho de las presiones parciales de la ecuación: Ptotal =(nRT/V) 1 (nRT/V) 2 (nRT/V) 3 ...
@@_
@@
Parte 2
el Cálculo Parcial, el Total de las Presiones
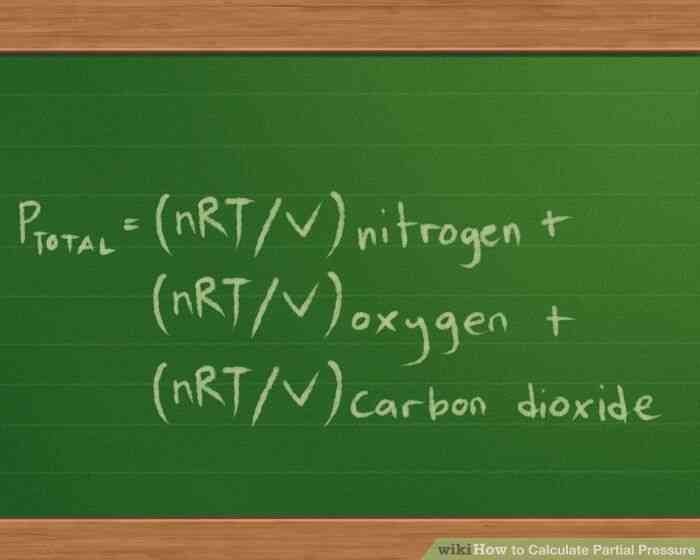
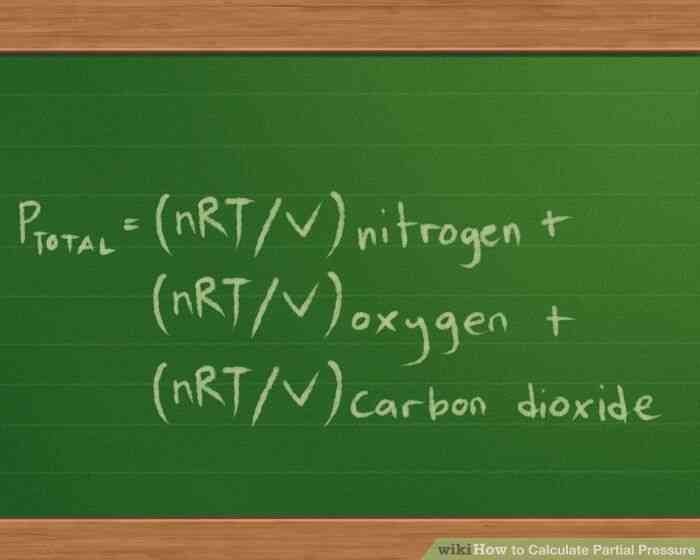
1
@@_
@@Definir la presión parcial de la ecuación de los gases que estás trabajando. Para los efectos de este cálculo, vamos a suponer que una de 2 litros frasco contiene 3 de gases: nitrógeno (N2), oxígeno (O2) y el dióxido de carbono (CO2). Hay 10 g de cada gas y la temperatura de cada gas en el matraz es de 37 ° C (98.6 ° F). Tenemos que encontrar la presión parcial de cada gas y la presión total de la mezcla de gas ejerce en el contenedor.
- Nuestra presión parcial ecuación se convierte en Ptotal = Pnitrogen Poxygen Pcarbon dióxido de carbono.
- Ya que estamos tratando de encontrar la presión de cada gas ejerce, sabemos que el volumen y la temperatura, y se puede encontrar el número de moles de cada gas es actual, basado en la masa, podemos reescribir esta ecuación como : Ptotal =(nRT/V) nitrógeno (nRT/V) de oxígeno (nRT/V) el dióxido de carbono


2
@@_
@@Convertir la temperatura en grados Kelvin. El Celsius la temperatura es de 37 grados, por lo tanto, añadir 273 37 para obtener 310 grados K.
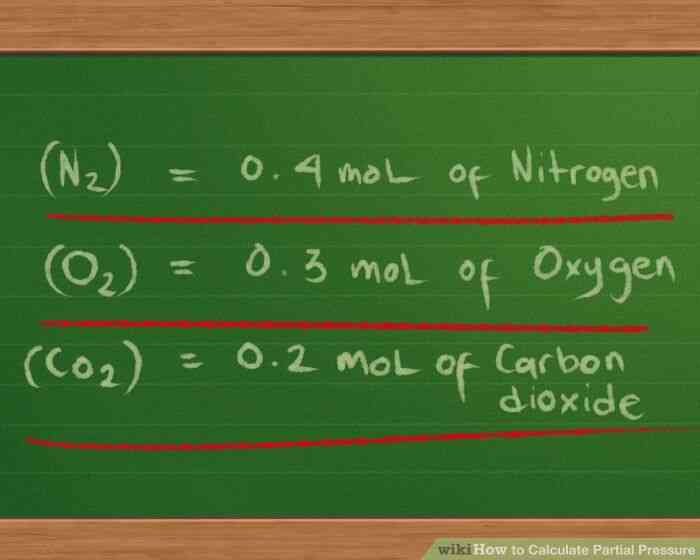
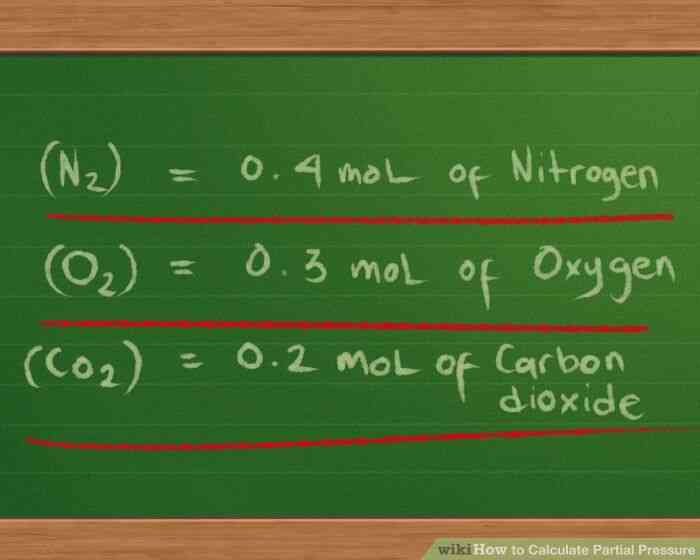
3
@@_
@@Hallar el número de moles de cada gas presente en la muestra. El número de moles de un gas es la masa de gas dividida por su masa molar,[13], que nos dijeron que era la suma de los pesos atómicos de cada átomo en un compuesto.
- Para nuestro primer gas, nitrógeno (N2), cada átomo tiene un peso atómico de 14. Debido a que el nitrógeno es diatómico (formularios de dos átomos de las moléculas), tenemos que multiplicar 14 por 2 para encontrar que el nitrógeno en nuestra muestra tiene una masa molar de 28. Nosotros, a continuación, dividir la masa en gramos, 10 g, 28, para obtener el número de moles, que veremos aproximado de 0,4 moles de nitrógeno.
- Para nuestra segunda gas, oxígeno (O2), cada átomo tiene un peso atómico de 16. El oxígeno también es diatómico, por lo que se multiplican 16 por 2 para encontrar el oxígeno en la muestra tiene una masa molar de 32. Dividiendo 10 g por 32 nos da aproximadamente 0,3 mol de oxígeno en nuestra muestra.
- Nuestro tercer gas, dióxido de carbono (CO2), tiene 3 átomos: uno de carbono, con un peso atómico de 12 y dos de oxígeno, cada uno con un peso atómico de 16. Añadimos las tres pesos: 12 16 16 = 44 como la masa molar. Dividiendo 10 g por 44 nos da aproximadamente 0,2 mol de dióxido de carbono.
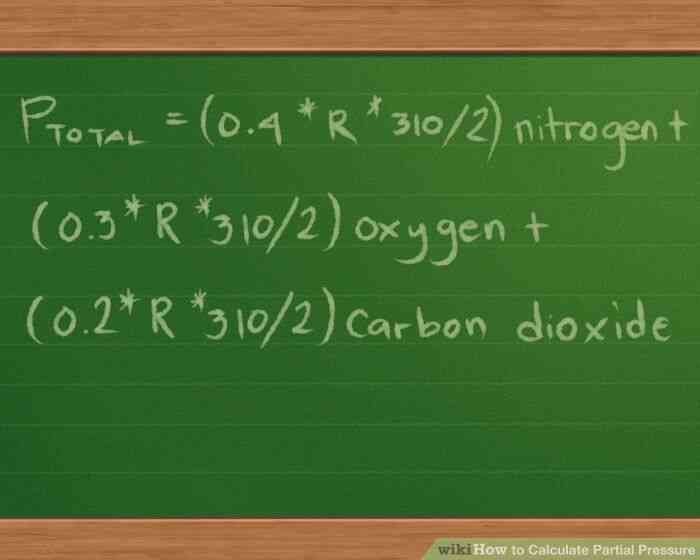
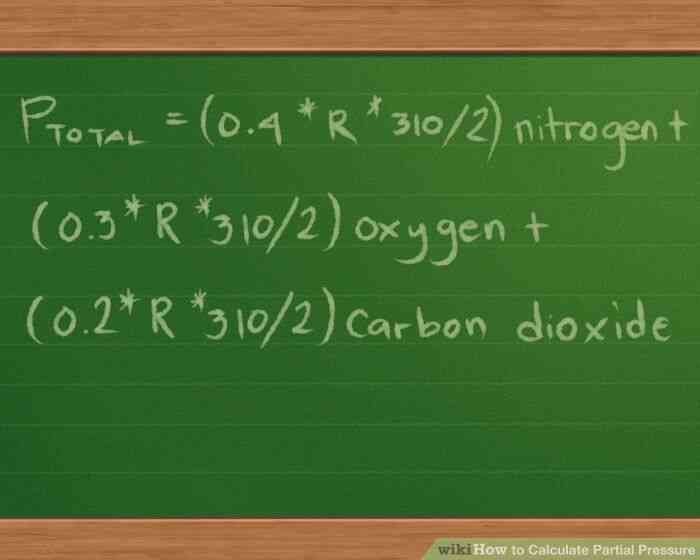
4
@@_
@@Enchufe en los valores de los moles, el volumen y la temperatura. Nuestra ecuación quedaría así: Ptotal =(0.4 * R * 310/2) nitrógeno (0.3 *R * 310/2) oxígeno (0.2 * R *310/2) de dióxido de carbono.
- Por razones de simplicidad, hemos dejado fuera de las unidades de medida de acompañamiento de los valores. Estas unidades se cancelan después de hacer los cálculos, dejando sólo la unidad de medida que estamos utilizando para el informe de las presiones en.
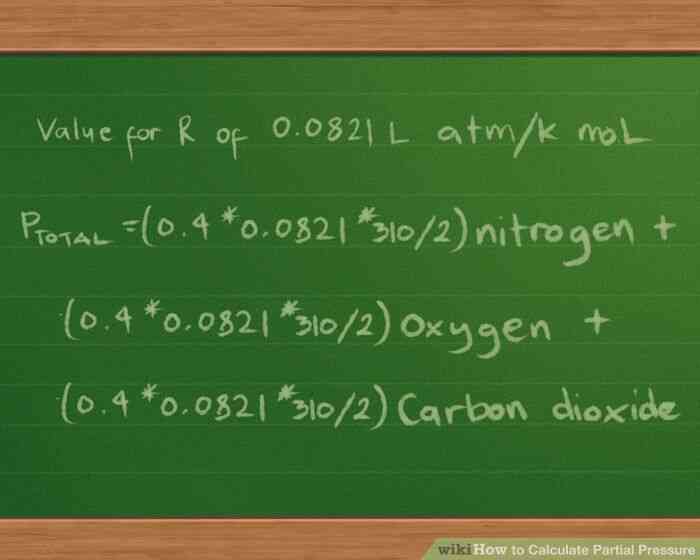
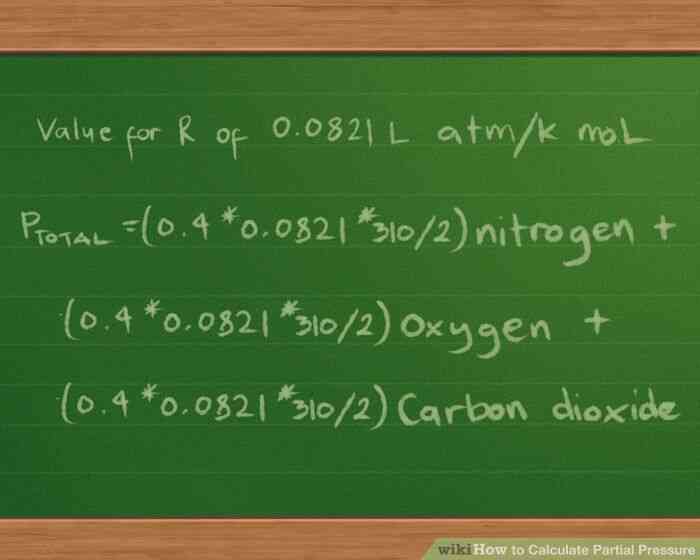
5
@@_
@@Enchufe en el valor de la constante R. vamos a informe parcial y total de las presiones en atmósferas, por lo que utilizaremos el valor de R de 0.0821 L atm/K mol. Conectar este valor en la ecuación nos da ahora Ptotal =(0.4 * 0.0821 * 310/2) nitrógeno (0.3 *0.0821 * 310/2) oxígeno (0.2 * 0.0821 * 310/2) de dióxido de carbono.
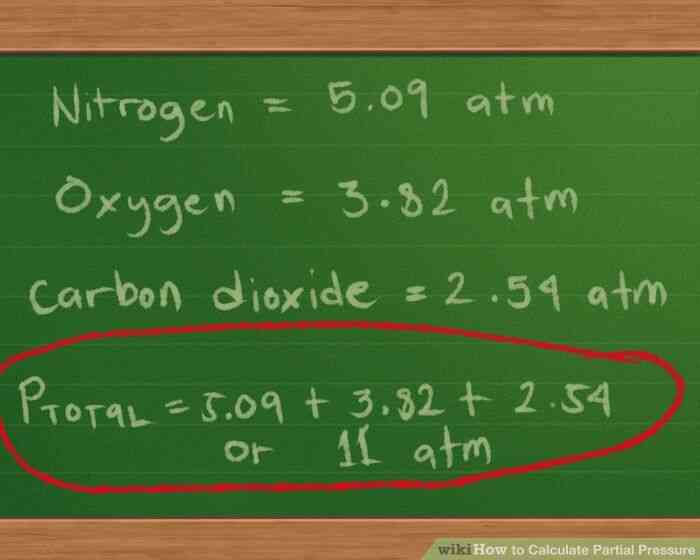
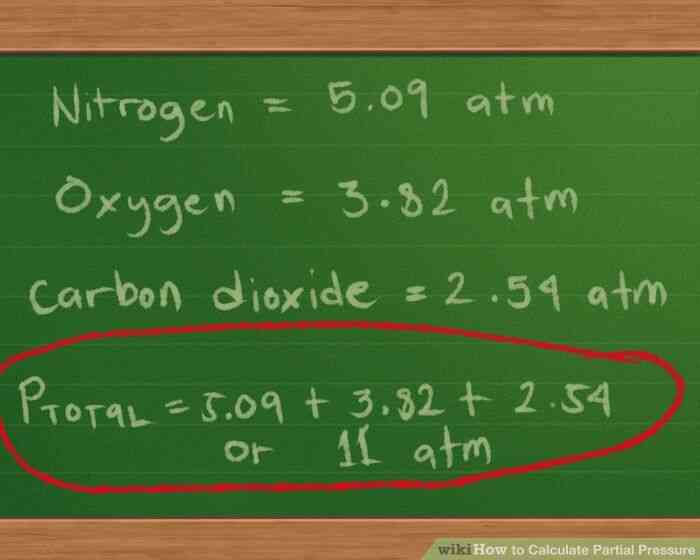
6
@@_
@@Calcular las presiones parciales de cada gas. Ahora que tenemos los valores en su lugar, es hora de hacer cuentas.
- Para la presión parcial de nitrógeno, se multiplica 0.4 mol por nuestro constante de 0.0821 y nuestra temperatura de 310 grados K, luego se divide por 2 litros: 0.4 * 0.0821 * 310/2 = 5.09 atm, aproximadamente.
- Para la presión parcial de oxígeno, se multiplica 0,3 mol por nuestro constante de 0.0821 y nuestra temperatura de 310 grados K, luego se divide por 2 litros: 0.3 *0.0821 * 310/2 = 3.82 atm, aproximadamente.
- Para la presión parcial de dióxido de carbono, se multiplica 0.2 mol por nuestro constante de 0.0821 y nuestra temperatura de 310 grados K, luego se divide por 2 litros: 0.2 * 0.0821 * 310/2 = 2.54 atm, aproximadamente.
- ahora añadimos las presiones de encontrar la presión total: Ptotal = 5.09 3.82 2.54, o 11.45 atm, aproximadamente.
@@_
@@
3
Calcular el Total, entonces las Presiones Parciales
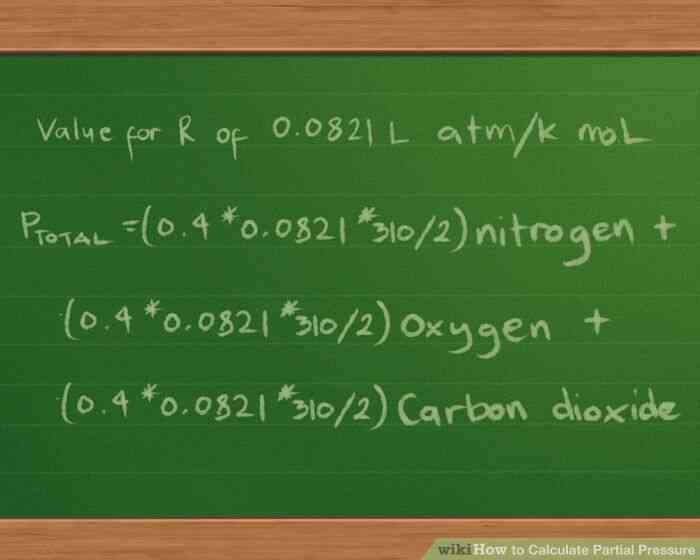
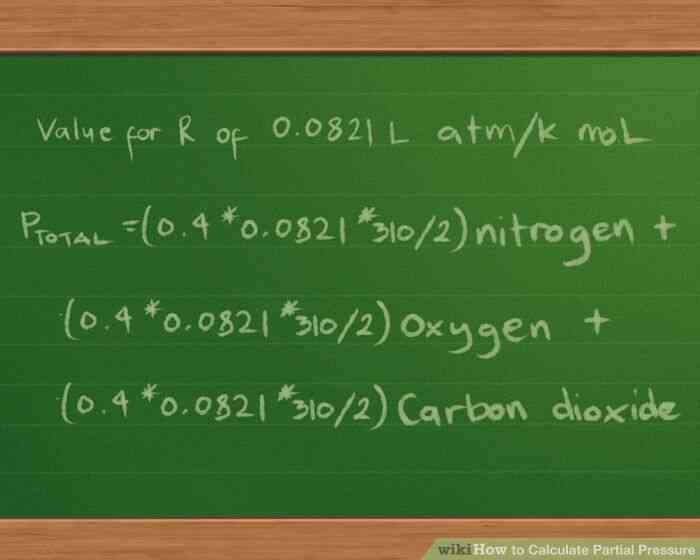
1
@@_
@@Definir la presión parcial ecuación como antes. De nuevo, vamos a suponer que una de 2 litros frasco de 3 gases: nitrógeno (N2), oxígeno (O2) y el dióxido de carbono (CO2). Hay 10 g de cada gas y la temperatura de cada gas en el matraz es de 37 ° C (98.6 grados F).
- La temperatura en grados Kelvin todavía será 310 grados, y, como antes, tenemos aproximadamente 0,4 moles de nitrógeno, 0,3 mol de oxígeno, y 0,2 moles de dióxido de carbono.
- Asimismo, seguiremos informe de la presión en atmósferas, por lo que utilizaremos el valor de 0.0821 L atm/K mol para el R constante.
- por Lo tanto, nuestro presiones parciales de la ecuación sigue siendo el mismo en este punto: Ptotal =(0.4 * 0.0821 * 310/2) nitrógeno (0.3 *0.0821 * 310/2) oxígeno (0.2 * 0.0821 * 310/2) de dióxido de carbono.


2
@@_
@@Agregar el número de moles de cada gas en la muestra para calcular el número total de moles en la mezcla de gas. Debido a que el volumen y la temperatura son las mismas para cada una de las muestras en el gas, por no hablar de cada molar valor se multiplica por la misma constante, podemos usar la propiedad distributiva de las matemáticas para reescribir la ecuación como Ptotal = (0.4 0.3 0.2) * 0.0821 * 310/2.
- Añadir 0.4 0.3 0.2 = 0,9 mol de mezcla de gases. Esto simplifica aún más la ecuación para Ptotal = 0.9 * 0.0821 * 310/2.
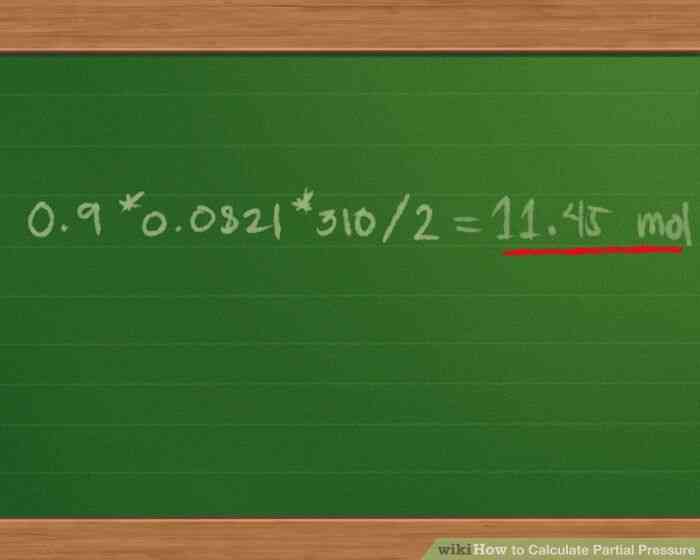
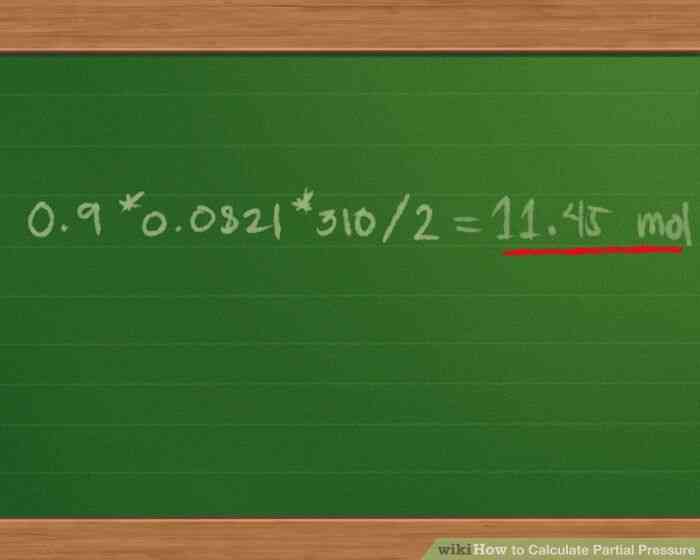
3
@@_
@@Encontrar la presión total de la mezcla de gas. Multiplicando 0.9 * 0.0821 * 310/2 = 11.45 mol, aproximadamente.


4
@@_
@@Encontrar la proporción de cada gas hace de la mezcla total. Para ello, se divide el número de moles de cada gas en el número total de moles.
- Hay un 0,4 moles de nitrógeno, por lo 0.4/0.9 = 0.44 (44 por ciento) de la muestra, aproximadamente.
- Hay 0.3 moles de nitrógeno, por lo 0.3/0.9 = 0.33 (33 por ciento) de la muestra, aproximadamente.
- No son de 0,2 mol de dióxido de carbono, por lo 0.2/0.9 = 0.22 (22 por ciento) de la muestra, aproximadamente.
- Mientras que el anterior porcentaje aproximado añadir a solo 0.99, el real decimales se repiten, por lo que la suma sería real de ser la repetición de una serie de 9s después de la coma decimal. Por definición, este es igual a 1 o 100 por ciento.
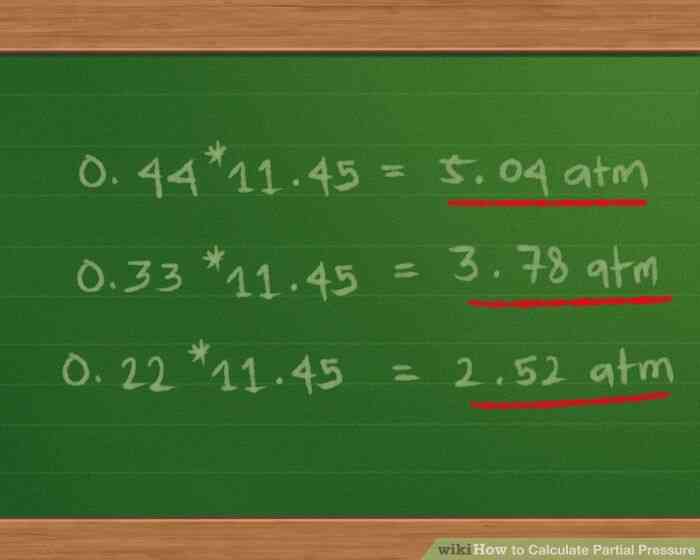
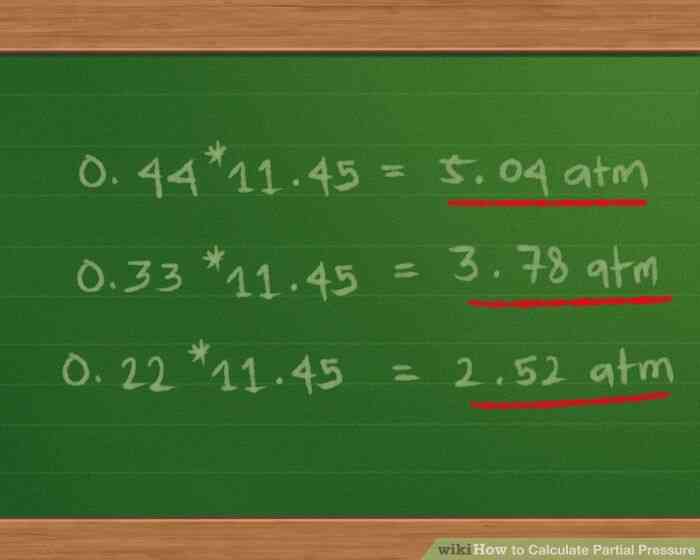
5
@@_
@@Multiplicar la cantidad proporcional de cada gas por el total de la presión para encontrar la presión parcial.
- Multiplicando 0.44 * 11.45 = 5.04 atm, aproximadamente.
- Multiplicando 0.33 * 11.45 = 3.78 atm, aproximadamente.
- Multiplicando 0.22 * 11.45 = 2.52 atm, aproximadamente.
Como Calcular la Presion Parcial de
En quimica, la "presion parcial" se refiere a las presiones que cada gas en una mezcla de gases que se ejerce en contra de su entorno, como una muestra del matraz, un buzo en el tanque de aire, o el limite de una atmosfera. Se puede calcular la presion de cada gas en la mezcla si usted sabe cuanto de eso hay, ¿que volumen ocupa, y su temperatura. A continuacion, puede agregar estas presiones parciales juntos para encontrar la presion total de la mezcla de gases, o, usted puede encontrar el total de la presion primero y luego buscar las presiones parciales.
Medidas
@@_
@@
1
la Comprension de las Propiedades de los Gases


1
@@_
@@Tratar cada gas como un 'ideal' de gas. Un gas ideal, en la quimica, es la que interactua con otros gases sin ser atraidos a sus moleculas. Las moleculas individuales pueden golpear el uno al otro y rebotan como bolas de billar, sin deformarse en forma alguna.[1]
- Las presiones de los gases ideales, aumentar a medida que se reducen a espacios mas pequeños y disminuir a medida que se expanden en areas mas grandes. Esta relacion se denomina Ley de Boyle, despues de que Robert Boyle. Esta escrito matematicamente como k = P x V o, mas simplemente, k = PV, donde k representa la constante relacion, P es la presion y V representa el volumen.[2]
- Presiones puede ser determinado usando uno de los varios posibles unidades. Uno es el pascal (Pa), que se define como una fuerza de un newton aplicado sobre un metro cuadrado. Otra es la atmosfera (atm), que se define como la presion de la atmosfera de la Tierra a nivel del mar. Una presion de 1 atm es igual a 101,325 Pa.[3]
- las temperaturas de Los gases ideales, como aumentar sus volumenes de aumento y disminucion de sus volumenes disminuir. Esta relacion se denomina Ley de Charles despues de Jacques Charles. Esta escrito matematicamente como k = V / T, donde k representa la constante relacion entre el volumen y la temperatura, V de nuevo representa el volumen, y T representa la temperatura. [4][5]
- Temperaturas de los gases en esta ecuacion se expresa en grados Kelvin, que se encuentran por la adicion de 273 para el numero de grados Celsius en el gas de la temperatura.
- Estas dos relaciones se pueden combinar en una sola ecuacion: k = PV / T, que tambien puede ser escrito como PV = kT.


2
@@_
@@Definir las cantidades de los gases se miden en. Los Gases tienen masa y volumen. El volumen se suele medir en litros (l), pero hay dos tipos de masa.
- Convencional de la masa se mide en gramos o, si no es suficientemente grande de masa, en kilogramos.
- Porque de lo ligero de los gases generalmente, estan tambien mide con otra forma de masa llamada masa molecular o masa molar. La masa Molar se define como la suma de los pesos atomicos de cada atomo en un compuesto, el gas esta compuesto de, con cada atomo comparado contra el valor de 12 de carbono.[6]
- Porque los atomos y las moleculas son demasiado pequeños para trabajar con cantidades de gases se define en moles. El numero de moles presentes en una determinada gas se puede encontrar dividiendo la masa por la masa molar y puede ser representado por la letra n.
- se puede sustituir la arbitrariedad de la constante k en la ecuacion de los gases con el producto de n, el numero de moles (mol), y una nueva constante R. La ecuacion puede ahora escribirse nR = PV/T o PV = nRT.[7]
- El valor de R depende de las unidades utilizadas para medir los gases' las presiones, volumenes y temperaturas. Para el volumen en litros, la temperatura en grados Kelvin, y la presion en atmosferas, su valor es 0.0821 L atm/K mol. Esto tambien puede ser escrito 0.0821 L atm K-1 mol -1 para evitar el uso de la division diagonal con las unidades de medida.[8]
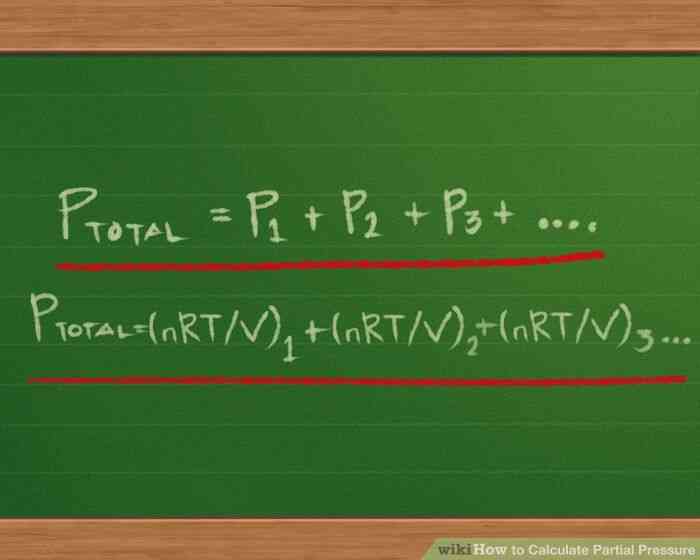
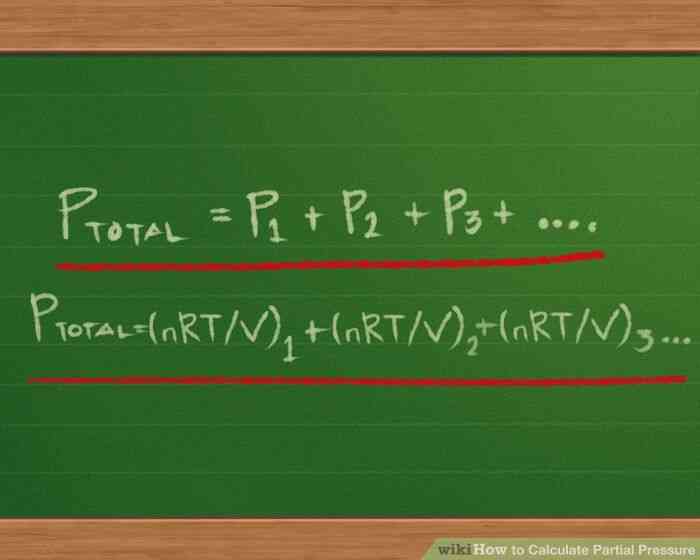
3
@@_
@@Entender la Ley de Dalton de las Presiones Parciales. Desarrollado por el quimico y el fisico John Dalton, quien primero propuso el concepto de elementos quimicos que se compone de atomos,[9][10][11] la Ley de Dalton establece que la presion total de una mezcla de gases es la suma de las presiones de cada uno de los gases en la mezcla.
- la Ley de Dalton puede ser escrito en forma de ecuacion como Ptotal = P1 P2 P3 ... con tantos sumandos despues del signo igual como hay gases en la mezcla.
- La Ley de Dalton de las ecuaciones puede ser ampliado cuando se trabaja con gases cuyos presiones parciales son desconocidos, pero para los que sabemos de sus volumenes y temperaturas. Un gas de la presion parcial es la misma presion que si la misma cantidad de gas que fueron el unico gas en el recipiente.[12]
- Para cada una de las presiones parciales, podemos reescribir la ecuacion del gas ideal, de modo que en lugar de la forma PV = nRT, nosotros solo puede tener P en el lado izquierdo del signo igual. Para ello, dividimos ambos lados por V: PV/V = nRT/V. Las dos V en el lado izquierdo cancelar, dejando P = nRT/V
- luego podemos sustituir cada subindice P en el lado derecho de las presiones parciales de la ecuacion: Ptotal =(nRT/V) 1 (nRT/V) 2 (nRT/V) 3 ...
@@_
@@
Parte 2
el Calculo Parcial, el Total de las Presiones
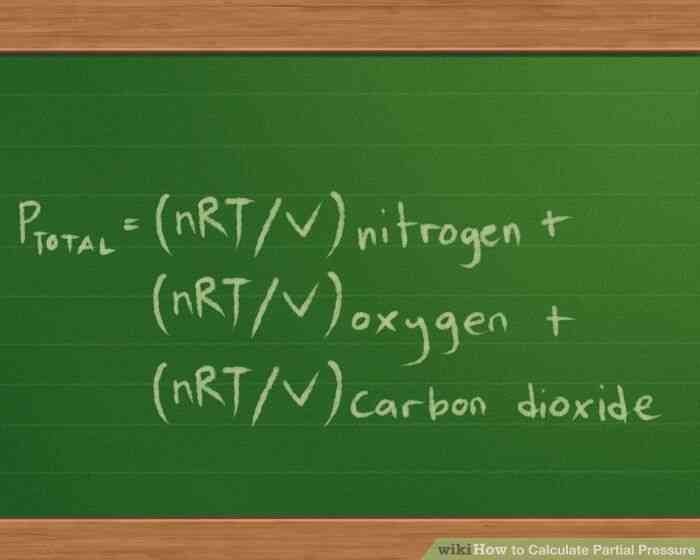
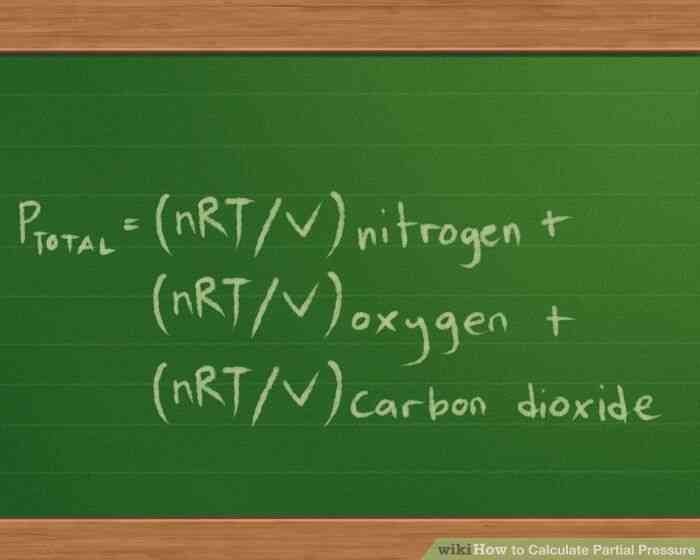
1
@@_
@@Definir la presion parcial de la ecuacion de los gases que estas trabajando. Para los efectos de este calculo, vamos a suponer que una de 2 litros frasco contiene 3 de gases: nitrogeno (N2), oxigeno (O2) y el dioxido de carbono (CO2). Hay 10 g de cada gas y la temperatura de cada gas en el matraz es de 37 ° C (98.6 ° F). Tenemos que encontrar la presion parcial de cada gas y la presion total de la mezcla de gas ejerce en el contenedor.
- Nuestra presion parcial ecuacion se convierte en Ptotal = Pnitrogen Poxygen Pcarbon dioxido de carbono.
- Ya que estamos tratando de encontrar la presion de cada gas ejerce, sabemos que el volumen y la temperatura, y se puede encontrar el numero de moles de cada gas es actual, basado en la masa, podemos reescribir esta ecuacion como : Ptotal =(nRT/V) nitrogeno (nRT/V) de oxigeno (nRT/V) el dioxido de carbono


2
@@_
@@Convertir la temperatura en grados Kelvin. El Celsius la temperatura es de 37 grados, por lo tanto, añadir 273 37 para obtener 310 grados K.
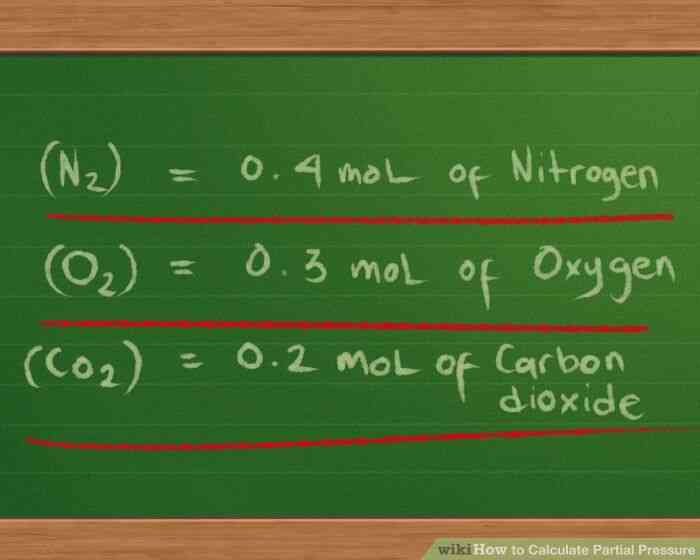
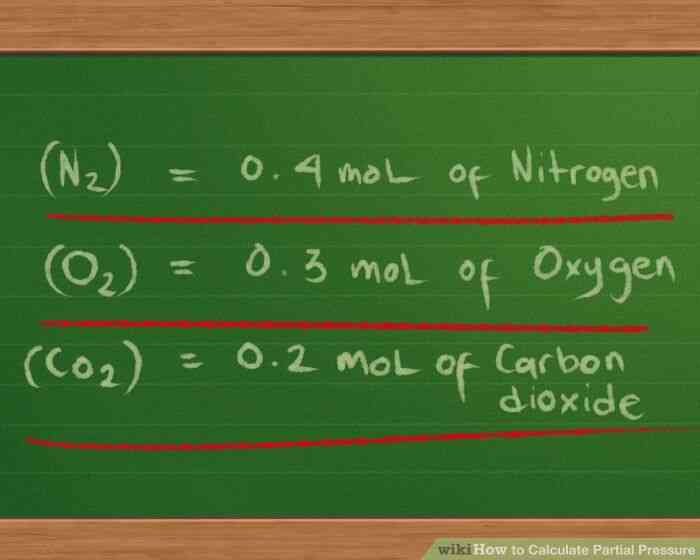
3
@@_
@@Hallar el numero de moles de cada gas presente en la muestra. El numero de moles de un gas es la masa de gas dividida por su masa molar,[13], que nos dijeron que era la suma de los pesos atomicos de cada atomo en un compuesto.
- Para nuestro primer gas, nitrogeno (N2), cada atomo tiene un peso atomico de 14. Debido a que el nitrogeno es diatomico (formularios de dos atomos de las moleculas), tenemos que multiplicar 14 por 2 para encontrar que el nitrogeno en nuestra muestra tiene una masa molar de 28. Nosotros, a continuacion, dividir la masa en gramos, 10 g, 28, para obtener el numero de moles, que veremos aproximado de 0,4 moles de nitrogeno.
- Para nuestra segunda gas, oxigeno (O2), cada atomo tiene un peso atomico de 16. El oxigeno tambien es diatomico, por lo que se multiplican 16 por 2 para encontrar el oxigeno en la muestra tiene una masa molar de 32. Dividiendo 10 g por 32 nos da aproximadamente 0,3 mol de oxigeno en nuestra muestra.
- Nuestro tercer gas, dioxido de carbono (CO2), tiene 3 atomos: uno de carbono, con un peso atomico de 12 y dos de oxigeno, cada uno con un peso atomico de 16. Añadimos las tres pesos: 12 16 16 = 44 como la masa molar. Dividiendo 10 g por 44 nos da aproximadamente 0,2 mol de dioxido de carbono.
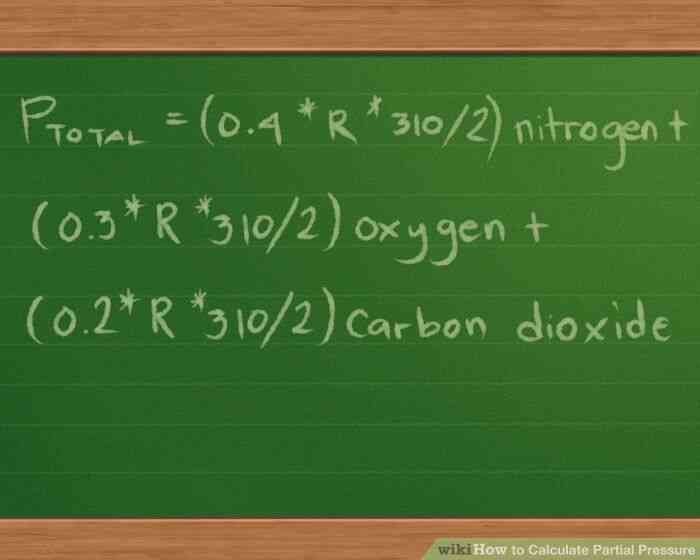
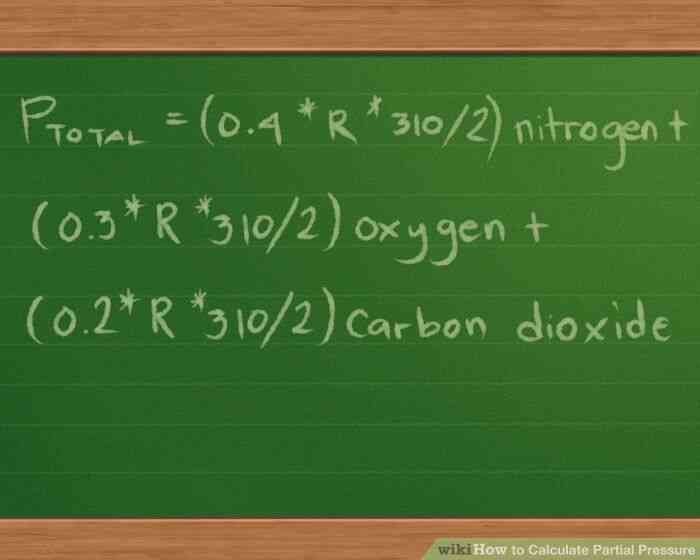
4
@@_
@@Enchufe en los valores de los moles, el volumen y la temperatura. Nuestra ecuacion quedaria asi: Ptotal =(0.4 * R * 310/2) nitrogeno (0.3 *R * 310/2) oxigeno (0.2 * R *310/2) de dioxido de carbono.
- Por razones de simplicidad, hemos dejado fuera de las unidades de medida de acompañamiento de los valores. Estas unidades se cancelan despues de hacer los calculos, dejando solo la unidad de medida que estamos utilizando para el informe de las presiones en.
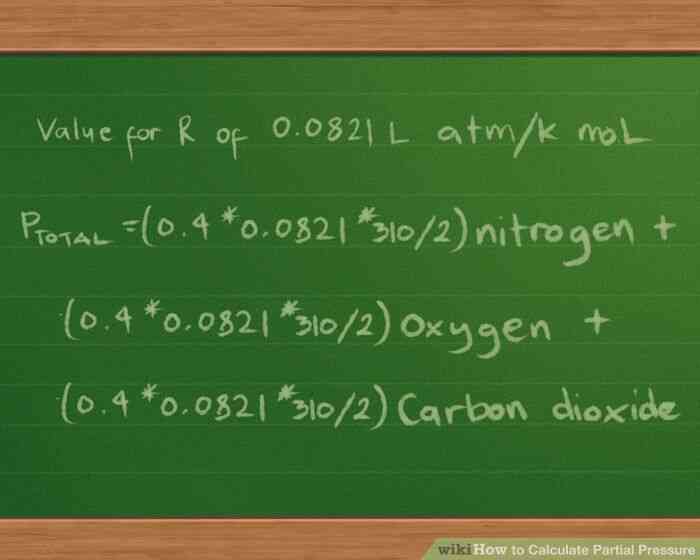
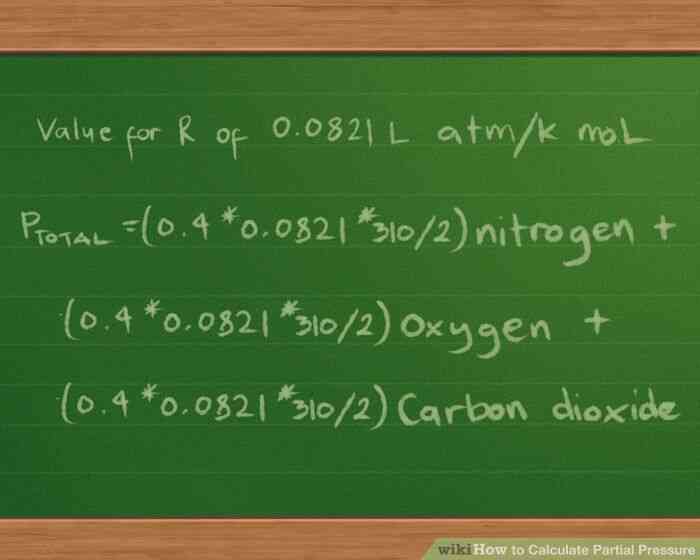
5
@@_
@@Enchufe en el valor de la constante R. vamos a informe parcial y total de las presiones en atmosferas, por lo que utilizaremos el valor de R de 0.0821 L atm/K mol. Conectar este valor en la ecuacion nos da ahora Ptotal =(0.4 * 0.0821 * 310/2) nitrogeno (0.3 *0.0821 * 310/2) oxigeno (0.2 * 0.0821 * 310/2) de dioxido de carbono.
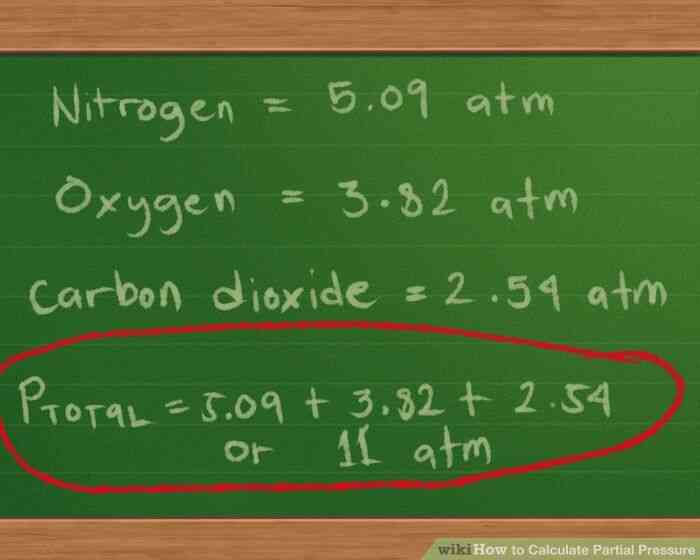
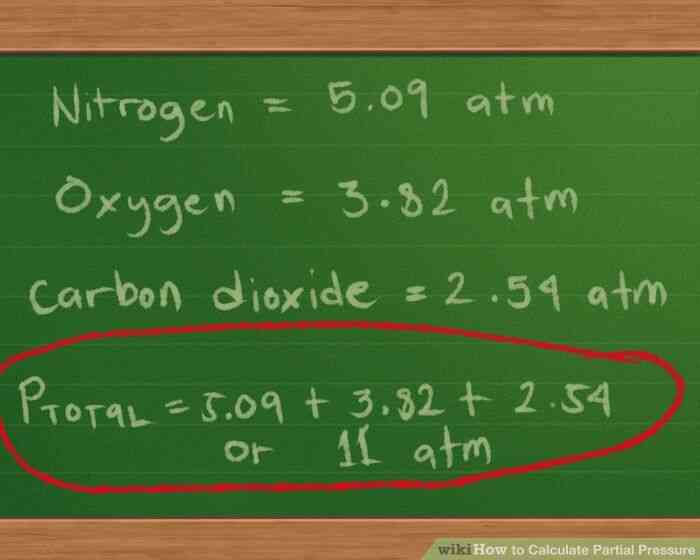
6
@@_
@@Calcular las presiones parciales de cada gas. Ahora que tenemos los valores en su lugar, es hora de hacer cuentas.
- Para la presion parcial de nitrogeno, se multiplica 0.4 mol por nuestro constante de 0.0821 y nuestra temperatura de 310 grados K, luego se divide por 2 litros: 0.4 * 0.0821 * 310/2 = 5.09 atm, aproximadamente.
- Para la presion parcial de oxigeno, se multiplica 0,3 mol por nuestro constante de 0.0821 y nuestra temperatura de 310 grados K, luego se divide por 2 litros: 0.3 *0.0821 * 310/2 = 3.82 atm, aproximadamente.
- Para la presion parcial de dioxido de carbono, se multiplica 0.2 mol por nuestro constante de 0.0821 y nuestra temperatura de 310 grados K, luego se divide por 2 litros: 0.2 * 0.0821 * 310/2 = 2.54 atm, aproximadamente.
- ahora añadimos las presiones de encontrar la presion total: Ptotal = 5.09 3.82 2.54, o 11.45 atm, aproximadamente.
@@_
@@
3
Calcular el Total, entonces las Presiones Parciales
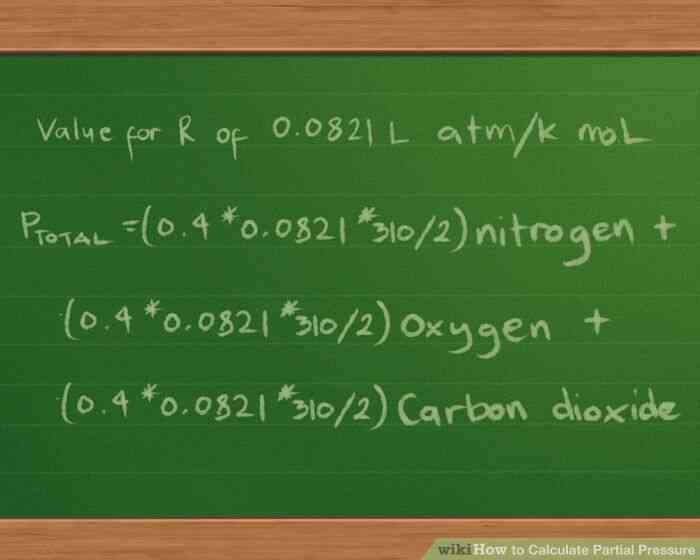
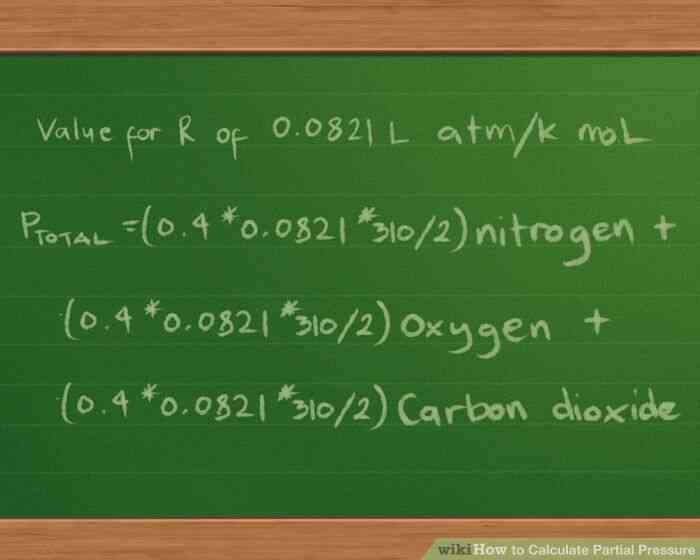
1
@@_
@@Definir la presion parcial ecuacion como antes. De nuevo, vamos a suponer que una de 2 litros frasco de 3 gases: nitrogeno (N2), oxigeno (O2) y el dioxido de carbono (CO2). Hay 10 g de cada gas y la temperatura de cada gas en el matraz es de 37 ° C (98.6 grados F).
- La temperatura en grados Kelvin todavia sera 310 grados, y, como antes, tenemos aproximadamente 0,4 moles de nitrogeno, 0,3 mol de oxigeno, y 0,2 moles de dioxido de carbono.
- Asimismo, seguiremos informe de la presion en atmosferas, por lo que utilizaremos el valor de 0.0821 L atm/K mol para el R constante.
- por Lo tanto, nuestro presiones parciales de la ecuacion sigue siendo el mismo en este punto: Ptotal =(0.4 * 0.0821 * 310/2) nitrogeno (0.3 *0.0821 * 310/2) oxigeno (0.2 * 0.0821 * 310/2) de dioxido de carbono.


2
@@_
@@Agregar el numero de moles de cada gas en la muestra para calcular el numero total de moles en la mezcla de gas. Debido a que el volumen y la temperatura son las mismas para cada una de las muestras en el gas, por no hablar de cada molar valor se multiplica por la misma constante, podemos usar la propiedad distributiva de las matematicas para reescribir la ecuacion como Ptotal = (0.4 0.3 0.2) * 0.0821 * 310/2.
- Añadir 0.4 0.3 0.2 = 0,9 mol de mezcla de gases. Esto simplifica aun mas la ecuacion para Ptotal = 0.9 * 0.0821 * 310/2.
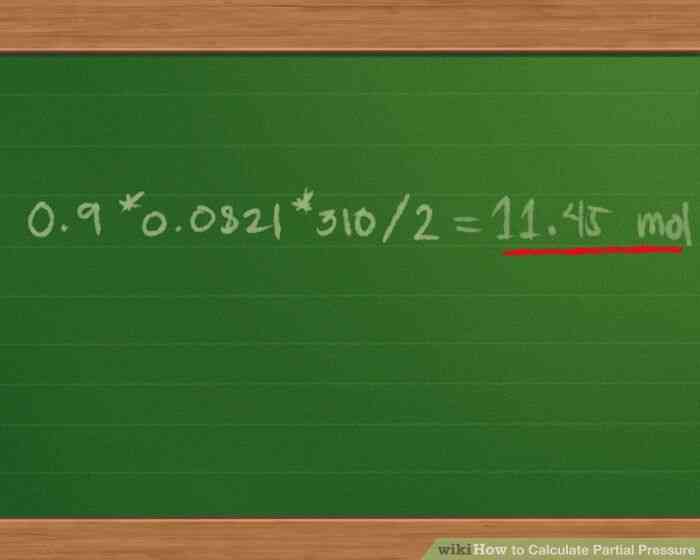
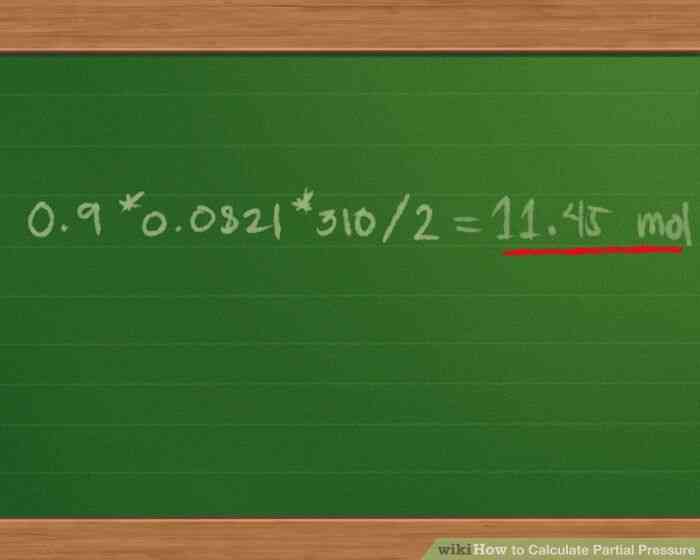
3
@@_
@@Encontrar la presion total de la mezcla de gas. Multiplicando 0.9 * 0.0821 * 310/2 = 11.45 mol, aproximadamente.


4
@@_
@@Encontrar la proporcion de cada gas hace de la mezcla total. Para ello, se divide el numero de moles de cada gas en el numero total de moles.
- Hay un 0,4 moles de nitrogeno, por lo 0.4/0.9 = 0.44 (44 por ciento) de la muestra, aproximadamente.
- Hay 0.3 moles de nitrogeno, por lo 0.3/0.9 = 0.33 (33 por ciento) de la muestra, aproximadamente.
- No son de 0,2 mol de dioxido de carbono, por lo 0.2/0.9 = 0.22 (22 por ciento) de la muestra, aproximadamente.
- Mientras que el anterior porcentaje aproximado añadir a solo 0.99, el real decimales se repiten, por lo que la suma seria real de ser la repeticion de una serie de 9s despues de la coma decimal. Por definicion, este es igual a 1 o 100 por ciento.
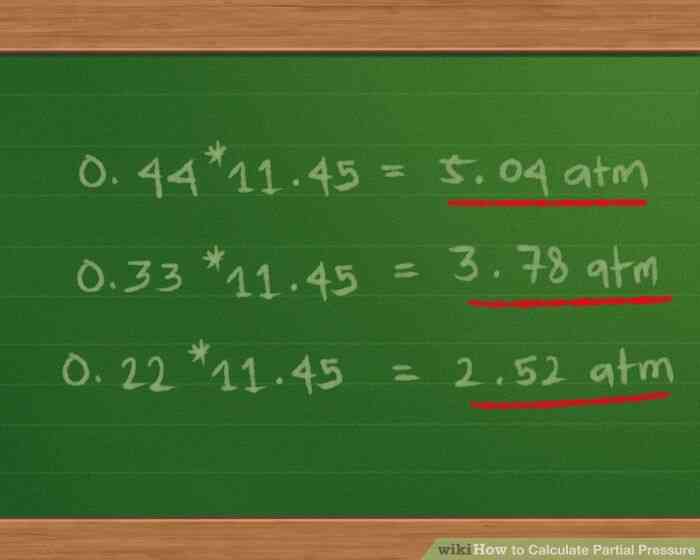
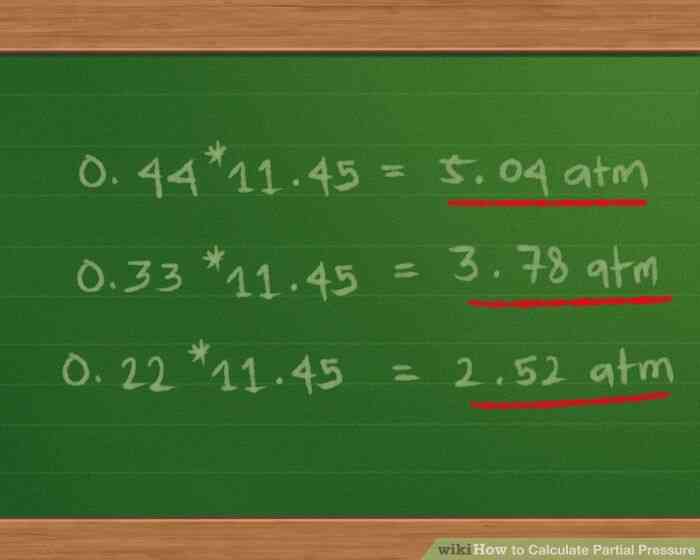
5
@@_
@@Multiplicar la cantidad proporcional de cada gas por el total de la presion para encontrar la presion parcial.
- Multiplicando 0.44 * 11.45 = 5.04 atm, aproximadamente.
- Multiplicando 0.33 * 11.45 = 3.78 atm, aproximadamente.
- Multiplicando 0.22 * 11.45 = 2.52 atm, aproximadamente.
Cómo Calcular la Presión Parcial de
By Consejos Y Trucos
En química, la "presión parcial" se refiere a las presiones que cada gas en una mezcla de gases que se ejerce en contra de su entorno, como una muestra del matraz, un buzo en el tanque de aire, o el límite de una atmósfera. Se puede calcular la presión de cada gas en la mezcla si usted sabe cuánto de eso hay, ¿qué volumen ocupa, y su temperatura. A continuación, puede agregar estas presiones parciales juntos para encontrar la presión total de la mezcla de gases, o, usted puede encontrar el total de la presión primero y luego buscar las presiones parciales.